您現在的位置: 百濟新特藥房網首頁 >> 行業資訊 >> 媒體報道
重磅!白血病新藥獲批,緩解率提高近3倍
- 來源: 百濟藥房藥訊 作者:百濟動態 瀏覽: 發布時間:2017/8/23 16:26:00
近,醫藥行業傳來一條重磅新聞——輝瑞(Pfizer)宣布,美國FDA加速批準了新藥BESPONSA(inotuzumab ozogamicin)上市,治療成人復發或難治性B細胞前體急性淋巴性白血病(B-cell precursor acute lymphoblastic leukemia)。值得一提的是,這是首款獲得美國FDA批準的靶向CD22的抗體藥物偶聯物(ADC)。
急性淋巴性白血病難點
急性淋巴性白血病是種侵襲性極高的白血病,在成人患者中的預后極差。目前,治療這種疾病的標準療法是長期的高強度化療。在初始治療后,有10%-20%的患者的病情無法得到有效緩解,這意味著他們對治療沒有產生響應。此外,在那些出現緩解的患者中,又有一半患者的病情會出現復發。據估計,疾病復發后的中位數生存期,僅為4.5個月到6個月。因此,這些患者急需創新的治療手段。
新藥創新之處
由輝瑞與其合作伙伴帶來的BESPONSA就是這樣一款充滿潛力的新療法。它是一款創新的抗體藥物偶聯物,由兩部分組成。其中一部分是靶向CD22的單克隆抗體,另一部分是細胞毒劑卡奇霉素(calicheamicin)。它的作用機理很容易理解:CD22抗原在B細胞表面普遍存在,因此這款抗體藥物偶聯物能夠靶向癌細胞,并與之表面的CD22抗原結合。隨后,這些抗體藥物偶聯物會被內吞入癌細胞。隨后,卡奇霉素會發揮它的功效,殺死癌細胞的。
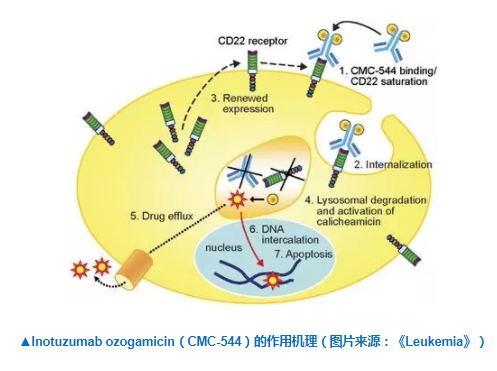
關鍵臨床數據參考
BESPONSA的安全性與療效在一項多中心的國際臨床試驗中得到了驗證。這項研究一共招募了326名成人患者。其中一部分接受BESPONSA治療,另一部分接受化療。研究發現,BESPONSA組中,患者的完全緩解率(CR)為81%,而化療組的數據僅為29%。在取得完全緩解的所有患者中,接受BESPONSA治療的患者中沒有小病灶殘留(MRD)的比例也更高,為78%,化療組是28%。此外,BESPONSA組患者的中位數總生存期為7.7個月,化療組的數據為6.2個月。安全性方面,研究人員指出這款新藥可能會帶來肝毒性。
基于BESPONSA在臨床上為患者帶來的改善,美國FDA在其申請上市后曾授予它優先審評資格,并于今日加速批準這款新藥上市。

新療法,新希望
“BESPONSA的批準對于復發性或難治性B細胞性淋巴性白血病的成人患者來說,是重要的一步。這是一種致命的罕見疾病,如果不治療,會在短短幾個月里奪去人的生命,”輝瑞腫瘤部的全球總裁Liz Barrett女士說道:“BESPONSA帶來了新療法,幫助解決了重大的需求,也能讓更多的患者堅持到進行干細胞移植的那一刻。想要取得長期緩解,這是的手段。能夠踐行對惡性血液癌癥患者的承諾,我們感到非常自豪。我們也將繼續為急性淋巴性白血病和其他血液癌癥找到新的治療方法。”
我們期待這款新藥的上市能為患者生活帶來重要改變,挽救更生命。
參考資料:
[1] Pfizer Receives U.S. FDA Approval for BESPONSA® (inotuzumab ozogamicin)
[2] Pfizer’s CD22-targeted cancer drug inotuzumab wins an accelerated OK at FDA
[3] FDA approves new treatment for adults with relapsed or refractory acute lymphoblastic leukemia
本文轉載自微信公眾號“藥明康德”
本文為轉載,我們不對其內容和觀點負責。








