您現在的位置: 百濟新特藥房網首頁 >> 肝病科 >> 脂肪肝 >> 脂肪肝常規用藥
09年美國肝病學會酒精性肝病診療指南(二)診斷及預后
- 來源: 《中華肝臟病雜志》 作者:百濟動態 瀏覽: 發布時間:2010/9/2 2:52:00
四、ALD的診斷
ALD的診斷包括大量飲酒史、肝病的臨床證據以及輔助檢查的異常。指南強調,這些指標常受到患者和醫生病史的采集以及實驗室檢測結果的限制。因為(1)否認酗酒及少報酒精攝入量在患者中很常見;(2)內科醫生往往低估酒精相關問題;(3)依靠查體和實驗室檢查都無法診斷ALD,尤其是在輕度ALD或早期肝硬化患者。指南建議內科醫生必須提高對患者可能存在ALD的警惕性以及依賴間接地酗酒證據,如對家庭成員進行問卷調查、咨詢或者用實驗室檢驗來驗證或確認臨床的懷疑。
ALD的診斷包括大量飲酒史、肝病的臨床證據以及輔助檢查的異常。指南強調,這些指標常受到患者和醫生病史的采集以及實驗室檢測結果的限制。因為(1)否認酗酒及少報酒精攝入量在患者中很常見;(2)內科醫生往往低估酒精相關問題;(3)依靠查體和實驗室檢查都無法診斷ALD,尤其是在輕度ALD或早期肝硬化患者。指南建議內科醫生必須提高對患者可能存在ALD的警惕性以及依賴間接地酗酒證據,如對家庭成員進行問卷調查、咨詢或者用實驗室檢驗來驗證或確認臨床的懷疑。
(一) 酒精濫用的篩選
臨床上經常由于不能有效的篩選患者,導致對酗酒診斷和治療的失敗。酒精濫用或酒精依賴的病史包括飲酒方式、類型、攝入量,以及酒精濫用導致的社會或心理問題的證據。這些可能通過其他方面的損傷或過去的創傷例如頻繁跌(摔)倒、撕裂、燒傷、骨折以及急診就診等提示。
臨床上經常由于不能有效的篩選患者,導致對酗酒診斷和治療的失敗。酒精濫用或酒精依賴的病史包括飲酒方式、類型、攝入量,以及酒精濫用導致的社會或心理問題的證據。這些可能通過其他方面的損傷或過去的創傷例如頻繁跌(摔)倒、撕裂、燒傷、骨折以及急診就診等提示。
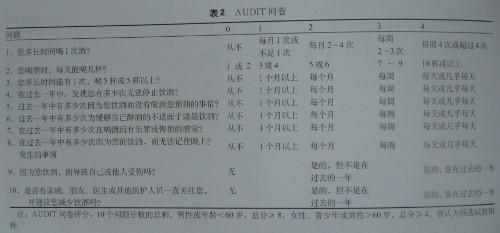
1. 問卷調查:指南認為,在酒精濫用篩查中生物化學試驗不如問卷調查靈敏,后者還可鑒別是否復發。并推薦數種調查問卷,包括CAGE、密歇根酒精中毒篩查試驗(MAST)以及酒精使用障礙鑒別測試(AUDIT)。結構性訪問通常作為量化終身飲酒史的金標準。指南主要推薦CAGE和AUDIT兩個問卷,見表1,2。

一項薈萃分析表明,CAGE問卷以超過2項陽性反應作為截斷值時,發現總體敏感性和特異性分別是0.71和0.90。其優點主要是問題簡單(只有四個是非選擇題),并可以包含在病史內作為書面文檔自我管理,由于他的長期實用性,仍用于大范圍的人群測試;缺點主要是注重攝入酒精的后果而不是實際飲用的酒精量,以及它反應行為的終身模式,而不是短期或最近的改變。
AUDIT可避免種族和文化的偏倚,它有更高的敏感性和特異性(初期調查的敏感性波動在51%-97%,特異性波動在78%-96%)。具有3個優點:可以區分還未發展為酒精依賴的“危險”飲酒者;包括了飲酒量的測定;還包括現在和終身的飲酒時間間隔。他可能在明確的酒精依賴或酗酒被診斷前就發現飲酒的問題,因此在不同人群可能更有力和更有效。AUDIT評分>8或者超過1d的大量飲酒,則篩查試驗陽性,提示需進一步評估以排除酒精濫用。
AUDIT可避免種族和文化的偏倚,它有更高的敏感性和特異性(初期調查的敏感性波動在51%-97%,特異性波動在78%-96%)。具有3個優點:可以區分還未發展為酒精依賴的“危險”飲酒者;包括了飲酒量的測定;還包括現在和終身的飲酒時間間隔。他可能在明確的酒精依賴或酗酒被診斷前就發現飲酒的問題,因此在不同人群可能更有力和更有效。AUDIT評分>8或者超過1d的大量飲酒,則篩查試驗陽性,提示需進一步評估以排除酒精濫用。
2. 血清生物化學指標檢測:長期使用酒精的血清標志物中,指南推薦①γ~谷氨酰轉肽酶(GGT),它可以為診斷酒精濫用以及飲酒問題提供獨立信息。然而,低靈敏度和特異性限制了GGT診斷酒精濫用的有效性,GGT的水平可以隨大面積肝損傷而波動。低水平的GGT(<100U/L)或者總膽紅素/GGT>1,已作為酒精性肝硬化患者1年病死率的預測因子。②平均紅細胞體積(MCV),酗酒者可出現巨紅細胞癥,但其敏感性低,結合GGT可能會提高診斷酒精濫用的敏感性。③糖缺失轉鐵蛋白,但其敏感性和特異性有限,它的試驗特性也受年齡、性別、體重指數以及其他慢性肝病等因素的影響。指南提示,由于單一指標往往缺乏敏感性和特異性,所以盡量避免依據某種單一的生物化學指標進行評價。
(二) 查體
ALD患者的查體可能出現從正常到進展性肝硬化。由于ALD可能與其他慢性肝病同時存在,所以其體格檢查的敏感性通常較低,即使在進展期肝病及肝硬化等有明顯體征的階段,查體的特征性表現也缺乏特異性。肝臟體積大小不一定能提供正確的信息,而且通常是正常的。腮腺體、掌攣縮、伴隨女性化在ALD更常見,但都缺乏特異性和敏感性。一些查體的特征可能會提示一些預后的信息,特異性體征的表現可能與1年期病死率的增加有關,如肝性腦病(相關的風險為4.0)、前腹壁靜脈顯露(2.2)、浮腫(2.9)、腹水(4.0)、蜘蛛痣(3.3)、乏力(2.1)等。AH時有極少數病例(4/240)在肝臟表面可聽到雜音,但指南建議謹慎地采納這個查體的診斷標準。
指南提醒內科醫生需要意識到ALD不是單獨存在的,它可能與酒精濫用所致的其他器官功能不全共存,包括心肌病、骨骼肌溶解、胰腺功能不全以及酒精性神經損傷等。在查體中必須尋找這些證據,以便提供更合適的治療。
ALD患者的查體可能出現從正常到進展性肝硬化。由于ALD可能與其他慢性肝病同時存在,所以其體格檢查的敏感性通常較低,即使在進展期肝病及肝硬化等有明顯體征的階段,查體的特征性表現也缺乏特異性。肝臟體積大小不一定能提供正確的信息,而且通常是正常的。腮腺體、掌攣縮、伴隨女性化在ALD更常見,但都缺乏特異性和敏感性。一些查體的特征可能會提示一些預后的信息,特異性體征的表現可能與1年期病死率的增加有關,如肝性腦病(相關的風險為4.0)、前腹壁靜脈顯露(2.2)、浮腫(2.9)、腹水(4.0)、蜘蛛痣(3.3)、乏力(2.1)等。AH時有極少數病例(4/240)在肝臟表面可聽到雜音,但指南建議謹慎地采納這個查體的診斷標準。
指南提醒內科醫生需要意識到ALD不是單獨存在的,它可能與酒精濫用所致的其他器官功能不全共存,包括心肌病、骨骼肌溶解、胰腺功能不全以及酒精性神經損傷等。在查體中必須尋找這些證據,以便提供更合適的治療。
(三) 實驗診斷
ALD的診斷是建立在過量飲酒以及存在肝病的基礎上。沒有單一的生物標記能夠明確的判定究竟是肝損傷的病因。對于一個多因素導致肝損傷的患者,很難評價酒精單獨起的作用,它可能是引起肝損傷系列因素中的一個。
對于重型AH患者,指南強調血漿AST的重要性。重型AH時,AST升高,達正常值上限的2-6倍,但很少超過500U/L或者ALT>200U/L,一旦超過常提示可能存在其他病因(如對乙酰氨基酚過量)。大約70%的患者AST/ALT>2,在無肝硬化的患者中可能更高,AST/ALT>3更能提示ALD。
ALD的診斷是建立在過量飲酒以及存在肝病的基礎上。沒有單一的生物標記能夠明確的判定究竟是肝損傷的病因。對于一個多因素導致肝損傷的患者,很難評價酒精單獨起的作用,它可能是引起肝損傷系列因素中的一個。
對于重型AH患者,指南強調血漿AST的重要性。重型AH時,AST升高,達正常值上限的2-6倍,但很少超過500U/L或者ALT>200U/L,一旦超過常提示可能存在其他病因(如對乙酰氨基酚過量)。大約70%的患者AST/ALT>2,在無肝硬化的患者中可能更高,AST/ALT>3更能提示ALD。
(四) 肝臟影像學
指南指出,超聲、CT以及磁共振等常用于診斷肝病,均可提示脂肪變性、肝硬化以及肝細胞癌的診斷,不能確定酒精作為肝病特異性病因,但可以排除酒精濫用患者肝臟異常的其他原因,例如膽管梗阻以及肝臟浸潤性或腫瘤性疾病。影像學提示酒精性肝硬化的特異性表現包括尾狀葉增大、肝右后葉切跡,與病毒性肝炎相比,酒精性肝硬化的再生結節更小。
指南指出,超聲、CT以及磁共振等常用于診斷肝病,均可提示脂肪變性、肝硬化以及肝細胞癌的診斷,不能確定酒精作為肝病特異性病因,但可以排除酒精濫用患者肝臟異常的其他原因,例如膽管梗阻以及肝臟浸潤性或腫瘤性疾病。影像學提示酒精性肝硬化的特異性表現包括尾狀葉增大、肝右后葉切跡,與病毒性肝炎相比,酒精性肝硬化的再生結節更小。
(五) 肝臟或組織檢查
肝臟或組織檢查在ALD的診斷中并不是必須的,但有助于判斷肝病的病因,因為超過20%有酒精濫用史的患者常存在次要的或共存的其他肝病病因,而且有益于確定ALD的分期和嚴重性。
組織學特征主要取決于損傷的程度和范圍。包括脂肪變性、小葉增生、匯管區纖維化、Mallory小體、細胞核空泡變性、膽管增生以及纖維化或硬化。這些在同一張切片中可能共存,然而都不能單獨地作為ALD特征性改變。AH的組織學可能有特異的組織學表現,包括融合結節壞死、脂肪變性、核周和細胞周圍膠原沉積、氣球樣變以及在早期即有靜脈周圍的炎癥。肝臟可能有多形核白細胞浸潤和Mallory小體。
組織學特異性的表現也有助于預后的判斷。多形核白細胞浸潤程度、膽汁淤積等提示ALD預后不良。巨大線粒體的出現可能提示為輕型AH,肝硬化和并發癥的發生率較低,具有良好的長期生存率。靜脈周圍和細胞周圍纖維化,預示AH可能會發展至肝硬化,尤其在繼續飲酒或者合并丙型肝炎病毒感染者,還可預測嚴重AH使用皮質類固醇治療的反應。
指南同時指出,如果無需進行對ALD或AH的治療,應用無創性檢查即可對患者的預后進行評估,通常就不需要組織學診斷;相反,如果需要設計一個實驗性的治療,或進行具有風險性的治療,那么就要進行肝臟或組織檢查的風險/獲益比的判定。
肝臟或組織檢查在ALD的診斷中并不是必須的,但有助于判斷肝病的病因,因為超過20%有酒精濫用史的患者常存在次要的或共存的其他肝病病因,而且有益于確定ALD的分期和嚴重性。
組織學特征主要取決于損傷的程度和范圍。包括脂肪變性、小葉增生、匯管區纖維化、Mallory小體、細胞核空泡變性、膽管增生以及纖維化或硬化。這些在同一張切片中可能共存,然而都不能單獨地作為ALD特征性改變。AH的組織學可能有特異的組織學表現,包括融合結節壞死、脂肪變性、核周和細胞周圍膠原沉積、氣球樣變以及在早期即有靜脈周圍的炎癥。肝臟可能有多形核白細胞浸潤和Mallory小體。
組織學特異性的表現也有助于預后的判斷。多形核白細胞浸潤程度、膽汁淤積等提示ALD預后不良。巨大線粒體的出現可能提示為輕型AH,肝硬化和并發癥的發生率較低,具有良好的長期生存率。靜脈周圍和細胞周圍纖維化,預示AH可能會發展至肝硬化,尤其在繼續飲酒或者合并丙型肝炎病毒感染者,還可預測嚴重AH使用皮質類固醇治療的反應。
指南同時指出,如果無需進行對ALD或AH的治療,應用無創性檢查即可對患者的預后進行評估,通常就不需要組織學診斷;相反,如果需要設計一個實驗性的治療,或進行具有風險性的治療,那么就要進行肝臟或組織檢查的風險/獲益比的判定。
五、預后的評估
有關預后評估的方法主要是針對AH。指南主要推薦的評估方法是Maddrey判別函數(maddrey discriminant function,MDF),MDF=4.6x(患者的凝血酶原時間-對照凝血酶原時間)+總膽紅素(mg/dl)。患者的MDF評分≥32處于死亡的高風險,1各月內的病死率高達30%-50%,尤其合并有肝性腦病者將處于最高的風險。這是評估患者預后的一個動態模型,它隨時間的推移實驗室結果將發生變化,包括入院后第一周膽紅素的變化,與用氫化波尼松治療AH患者的預后有明顯相關。
推薦的其他常用的評分系統包括MELD評分、Glasgow AH評分、CTP評分和Lille model-PT模型,包括MDF均可在互聯網(www.lillemodel.com)上自動獲取這些模型的結果。由于內在的取舍,包括設定實驗閾值、最佳截斷值(切點)等對于每一個評分系統的指數都沒有明確的設定。一些調查者推薦這些指數的判斷界值,包括MDF≥32、MELD評分>11、GAHS評分>8,提示患者預后不良。作為預后不良高風險患者早期診斷的目標,需要一個敏感型最大的測試,使用MDF(截斷值為32和/或肝性腦病的出現)選擇患者的治療似乎比較合理。
有關預后評估的方法主要是針對AH。指南主要推薦的評估方法是Maddrey判別函數(maddrey discriminant function,MDF),MDF=4.6x(患者的凝血酶原時間-對照凝血酶原時間)+總膽紅素(mg/dl)。患者的MDF評分≥32處于死亡的高風險,1各月內的病死率高達30%-50%,尤其合并有肝性腦病者將處于最高的風險。這是評估患者預后的一個動態模型,它隨時間的推移實驗室結果將發生變化,包括入院后第一周膽紅素的變化,與用氫化波尼松治療AH患者的預后有明顯相關。
推薦的其他常用的評分系統包括MELD評分、Glasgow AH評分、CTP評分和Lille model-PT模型,包括MDF均可在互聯網(www.lillemodel.com)上自動獲取這些模型的結果。由于內在的取舍,包括設定實驗閾值、最佳截斷值(切點)等對于每一個評分系統的指數都沒有明確的設定。一些調查者推薦這些指數的判斷界值,包括MDF≥32、MELD評分>11、GAHS評分>8,提示患者預后不良。作為預后不良高風險患者早期診斷的目標,需要一個敏感型最大的測試,使用MDF(截斷值為32和/或肝性腦病的出現)選擇患者的治療似乎比較合理。
TAG:酒精性肝病 美國肝病學會 脂肪肝 肝纖維化 肝硬化
相關藥品








