您現在的位置: 百濟新特藥房網首頁 >> 肝病科 >> 丙肝 >> 丙肝常規用藥
派羅欣與佩樂能治療丙肝的對照研究最終結果公布
- 來源: 中國醫學論壇報 作者:百濟動態 瀏覽: 發布時間:2008-5-21 9:58:00
◆ 聚乙二醇干擾素(PEG-IFN)α-2b (佩樂能)組應答預測性更高,復發率更低
◆ PEG-IFN α-2a組實際接受了更大劑量的利巴韋林
在4月27日剛剛結束的2008年歐洲肝臟研究學會(EASL)年會上,美國約翰斯·霍普金斯大學醫學院病毒性肝炎中心主任Mark Sulkowski公布了IDEAL研究最終結果。IDEAL研究結果顯示,佩樂能組的應答預測性更高,復發率更低。無論是成功獲得持續病毒學應答的患者,還是停藥后復發或不應答者,亦或是利巴韋林減量或停藥患者,PEG IFN α-2a組聯合利巴韋林的實際用量都明顯大于任一佩樂能組。按照美國FDA批準方案設計的IDEAL研究,累計利巴韋林的實際用量并沒有偏向佩樂能組,相反卻有利于PEG-IFN α-2a組。
IDEAL研究目的與設計
IDEAL研究(Individualized Dosing Efficacy vs. flat dosing to Assess optimaL pegylated inter-feron therapy)是全球第一項隨機、對照、前瞻、頭對頭比較美國FDA批準的兩種丙型肝炎治療方案的大樣本臨床研究,旨在評估哪種療法是治療基因1型丙型肝炎的更優化治療方案。研究共分3組:①聚乙二醇干擾素(PEG-IFN)a-2b (佩樂能)標準劑量組(A組):佩樂能1.5 μg/(kg·w)聯合利巴韋林800~1400 mg/d;②PEG-IFNα-2a(派羅欣)標準劑量組(C組):PEG-IFNα-2a標準劑量(單一劑量180 μg/w)聯合利巴韋林1000~1200 mg/d;③ 作為先靈葆雅對美國FDA的承諾,IDEAL研究還同時比較了佩樂能標準劑量與佩樂能小劑量1.0 μg/(kg·w)聯合利巴韋林800~1400 mg/d (B組)的療效和安全性(圖1)。為了便于讀者閱讀,佩樂能標準劑量組(A組)簡寫為“佩樂能1.5組”,佩樂能小劑量組(B組)簡寫為“佩樂能1.0組”, PEG-IFNα-2a標準劑量組(C組)簡寫為“PEG2a 180組”。
IDEAL研究的主要終點為持續病毒學應答(SVR)率,次要終點包括復發率、應答預測等。
◆ PEG-IFN α-2a組實際接受了更大劑量的利巴韋林
在4月27日剛剛結束的2008年歐洲肝臟研究學會(EASL)年會上,美國約翰斯·霍普金斯大學醫學院病毒性肝炎中心主任Mark Sulkowski公布了IDEAL研究最終結果。IDEAL研究結果顯示,佩樂能組的應答預測性更高,復發率更低。無論是成功獲得持續病毒學應答的患者,還是停藥后復發或不應答者,亦或是利巴韋林減量或停藥患者,PEG IFN α-2a組聯合利巴韋林的實際用量都明顯大于任一佩樂能組。按照美國FDA批準方案設計的IDEAL研究,累計利巴韋林的實際用量并沒有偏向佩樂能組,相反卻有利于PEG-IFN α-2a組。
IDEAL研究目的與設計
IDEAL研究(Individualized Dosing Efficacy vs. flat dosing to Assess optimaL pegylated inter-feron therapy)是全球第一項隨機、對照、前瞻、頭對頭比較美國FDA批準的兩種丙型肝炎治療方案的大樣本臨床研究,旨在評估哪種療法是治療基因1型丙型肝炎的更優化治療方案。研究共分3組:①聚乙二醇干擾素(PEG-IFN)a-2b (佩樂能)標準劑量組(A組):佩樂能1.5 μg/(kg·w)聯合利巴韋林800~1400 mg/d;②PEG-IFNα-2a(派羅欣)標準劑量組(C組):PEG-IFNα-2a標準劑量(單一劑量180 μg/w)聯合利巴韋林1000~1200 mg/d;③ 作為先靈葆雅對美國FDA的承諾,IDEAL研究還同時比較了佩樂能標準劑量與佩樂能小劑量1.0 μg/(kg·w)聯合利巴韋林800~1400 mg/d (B組)的療效和安全性(圖1)。為了便于讀者閱讀,佩樂能標準劑量組(A組)簡寫為“佩樂能1.5組”,佩樂能小劑量組(B組)簡寫為“佩樂能1.0組”, PEG-IFNα-2a標準劑量組(C組)簡寫為“PEG2a 180組”。
IDEAL研究的主要終點為持續病毒學應答(SVR)率,次要終點包括復發率、應答預測等。

圖1 IDEAL研究設計
患者基線特征
IDEAL研究在全美118個主要肝病中心進行,共納入3070 例初治的基因1型丙型肝炎患者,其中男性患者占60%,71%為高加索人,19%為非洲裔美國人,平均年齡為47.5歲,平均體重83.4公斤。在所有患者中,82%為基因1型高病毒載量[HCV RNA>6×105 IU/ml,采用羅氏COBAS TaqMan檢測法,定量下限(LLQ)為27 IU/ml]。11%的患者存在F3/F4級肝纖維化。3組患者的基線特征相似,無顯著差異,具有可比性。
IDEAL研究結果
1. 持續病毒學應答
3組主要終點SVR率相似,佩樂能1.5 組、佩樂能1.0組和PEG2a 180組分別為40%、38 %和41%,無顯著差異。意向性分析(ITT)結果顯示,3組中初始利巴韋林劑量相同患者的SVR分別為40%、38 %和38% ,3組間亦無顯著差異。3組堅持888原則*患者的SVR分別為70%、74%和61% 。
*堅持888原則指堅持PEG-IFN推薦劑量的80%以上,利巴韋林劑量的80%以上,及推薦療程的80%以上。
2. 復發率
復發率是IDEAL研究的次要終點之一。有趣的是,IDEAL研究發現,雖然PEG2a 180組在治療結束時應答率(EOTR)較高,但佩樂能組停藥后的復發率更低,佩樂能1.5、佩樂能1.0及PEG2a 180組的復發率分別為24%、20%和32% (圖2)。根據研究初始設計,任何指標只要相差7%以上,在95%可信區間(CI)內不包括0,就表明有顯著統計學差異。佩樂能1.5、佩樂能1.0組的復發率分別比PEG 2a 180組低8%和12%,95%CI:-13.2%~-2.8%,不包含0,說明兩個佩樂能組與PEG 2a 180組的復發率均有顯著差異。

圖2 佩樂能1.5、佩樂能1.0和PEG 2a 180組的復發率
對復發危險因素的多元回歸分析發現,丙肝復發的高危因素從高到低依次為:
(1)基線病毒載量高:HCV RNA>6×105 IU/ml者復發危險明顯高于基線病毒載量≤6×105 IU/ml者(P<0.001);
(2) 年齡:年齡>40歲患者的復發危險明顯高于≤40歲患者(P<0.001);
(3) 肝纖維化:F3/F4級肝纖維化患者復發危險明顯高于F1/F2級肝纖維化者(P=0.001);
(4) PEG-IFN α-2a對比佩樂能1.0 μg/(kg.w):PEG 2a 180 μg/w聯合利巴韋林治療的復發危險顯著高于佩樂能1.0 μg/(kg·w)聯合治療(P<0.001);
(5) 空腹血糖水平:≥5.6 mmol/L患者的復發危險顯著高于<5.6 mmol/L者(P=0.002);
(6) 脂肪肝:有脂肪肝患者的復發危險顯著高于無脂肪肝者(P=0.002);
(7) 丙氨酸氨基轉移酶(ALT)水平:ALT正常者的復發危險明顯高于ALT升高者(P=0.008);
(8) PEG-IFN α-2a對比佩樂能1.5 μg/(kg·w):PEG2a 180 μg/w聯合利巴韋林治療的復發危險顯著高于佩樂能1.5 μg/(kg·w)聯合治療(P=0.012)。
3. 持續病毒學應答預測
第4周及第12周對患者進行血清HCV RNA檢測已經成為臨床上重要的常規檢測之一。根據第4周快速病毒學應答(RVR)及第12周早期病毒學應答(EVR)結果,可以預測治療48周結束后、隨訪24周時的SVR。
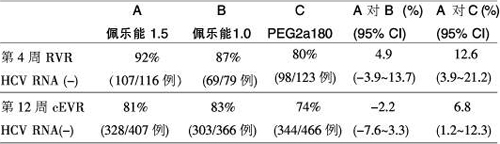
IDEAL研究結果再次證明了佩樂能聯合利巴韋林對SVR的高預測性:佩樂能1.5組第4周達到RVR的患者(HCV RNA陰性)有92%的可能將獲得SVR[陽性預測值(PPV)=92%],佩樂能1.0組第4周達到RVR的患者有87%的可能將獲得SVR(PPV=87%),PEG2a 180組達到RVR的患者有80%的可能獲得SVR(PPV=80%)。佩樂能1.5組比佩樂能1.0組高4.9%,95%CI:-3.9~13.7,中間含有0,因此兩個佩樂能組間無顯著差異。而佩樂能1.5組比PEG2a 180組高12.6%,95%CI:3.9~21.2,中間不含0,因此兩組間有統計學顯著差異,說明佩樂能1.5組第4周RVR的PPV顯著高于PEG2a 180組。
IDEAL研究中,第12周EVR定義為PEG-IFN治療第12周時血清HCV RNA轉陰,即完全EVR(cEVR)。根據第12周cEVR對SVR的預測,佩樂能1.5、佩樂能1.0及PEG2a 180 3組達到cEVR的SVR陽性預測率分別為:81%、83%和74%。統計學上,佩樂能1.0組比佩樂能1.5組高2.2%,95%CI:-7.6~3.3,中間含有0,因此兩個佩樂能組間無顯著差異。而佩樂能1.5組比PEG2a 180組高6.8%,95%CI:1.2~12.3,中間不含0,因此兩組間有統計學顯著差異,說明佩樂能1.5組第12周cEVR的PPV顯著高于PEG 2a 180組(表1)。
表1 第4周及第12周cEVR的SVR陽性預測值
4. 利巴韋林使用劑量
在IDEAL研究最終結果公布之前,各組間利巴韋林劑量分布始終是肝病學界爭議的焦點。IDEAL研究比較的是美國FDA批準的兩種丙型肝炎治療方案,而佩樂能組與PEG2a組中利巴韋林的初始劑量及因不良反應減量方案存在較大差異。佩樂能組聯合利巴韋林的初始劑量按40~65 kg、>65 kg~<75 kg、≥75~85 kg、>85~105 kg和>105 kg 5個體重區間分別給予800~1400 mg/d。PEG2a 180聯合利巴韋林組根據美國說明書按<75 kg和≥75 kg 2個體重區間分別給予1000~1200 mg/d的初始劑量。根據初始劑量的計算方法,初始利巴韋林劑量取決于患者體重。當1例體重在40~65 kg之間的患者隨機進入佩樂能組時,他的利巴韋林初始劑量為800 mg/d,而同樣體重的患者隨機進入PEG2a 180組時,他的利巴韋林初始劑量為1000 mg/d。對于體重在40~65 kg區間的患者,進入PEG2a 180組的初始利巴韋林劑量將大于進入佩樂能組所聯合的利巴韋林劑量。依此類推可以得出初始利巴韋林使用劑量表(表2)。
表2 初始利巴韋林劑量及減量方案

關于IDEAL研究爭議的焦點是方案中PEG2a 180組利巴韋林的減量問題。從表2中可以看出,佩樂能組如果初始利巴韋林劑量為800~1200 mg/d,第1次減量和第2次減量都為每次200 mg。而PEG2a 180組按照美國FDA批準的說明書,每次減量為600 mg,第1次減量幅度明顯大于佩樂能組。因此有學者提出,佩樂能組與PEG2a 180組的利巴韋林減量方案不一致,利巴韋林的實際用量可能有利于佩樂能組,而對PEG2a 180組不利。
眾所周知,利巴韋林在防止PEG-IFN停藥后丙肝復發上起關鍵作用,利巴韋林用量越大,復發率越低;而利巴韋林用量越小,復發率越高。據此有學者懷疑PEG2a 180組的高復發率可能與減量后利巴韋林累計用量偏小有關。隨著IDEAL研究最終結果的公布,各組利巴韋林的實際用量也終于浮出水面。
IDEAL研究最終結果表明,各組患者利巴韋林的實際累計用量沒有偏向佩樂能組。相反,無論是獲得SVR的患者,亦或是停藥后復發或不應答患者,還是利巴韋林減量或停藥患者,PEG2a 180組聯合利巴韋林的用量均顯著大于任一佩樂能組。
根據最終實際入組患者的體重分布,3組聯合利巴韋林的初始劑量如圖3所示。體重在>65 kg~<75 kg(利巴韋林:1000 mg)和>85~105 kg(利巴韋林1200 mg)的患者占所有患者的51%,這部分患者的初始利巴韋林劑量相同。IDEAL研究中患者的平均體重為84 kg,體重在≥75~85 kg之間的患者占39%,這部分患者如果隨機進入PEG2a 180組,利巴韋林的用量大于佩樂能組。只有10%體重>105 kg的患者隨機進入佩樂能組的初始利巴韋林劑量大于PEG2a 180組。從3組初始利巴韋林使用劑量來看,反而可能有利于PEG2a 180組。
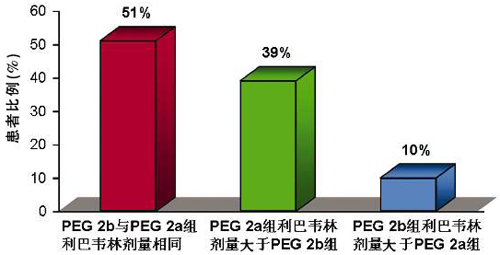
圖3 根據研究方案分配的初始利巴韋林劑量
在利巴韋林減量或停藥情況下,是否會因為減量方案的差異造成PEG2a 180組利巴韋林用量偏小呢?IDEAL研究最終結果表明,根據研究設計的減量方案進行減量,PEG2a 180組聯合利巴韋林的實際用量也明顯大于任一佩樂能組。IDEAL研究設計的減量方案并沒有偏向佩樂能組,相反卻有利于PEG2a 180組,60%以上利巴韋林減量或停藥患者的利巴韋林實際用量大于佩樂能1.5或佩樂能1.0組(圖4)。
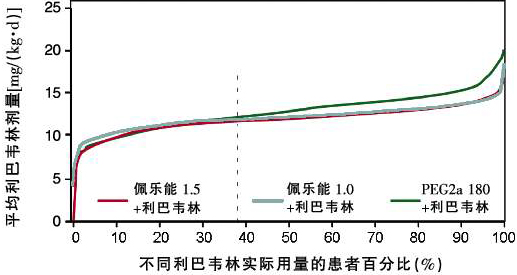
圖4 利巴韋林減量或停藥患者的實際利巴韋林用量
#佩樂能1.5對比PEG2a 180組P<0.001
*佩樂能1.0對比PEG2a 180 組P≤0.001
從圖5可以看出,無論最終獲得SVR的患者,還是復發或不應答患者,PEG2a 180組聯合利巴韋林劑量都明顯大于任一佩樂能組。每組最終的利巴韋林實際用量說明,IDEAL研究中利巴韋林使用劑量沒有偏向佩樂能組,相反卻更有利于PEG2a 180組。

圖5 不同應答亞組中,佩樂能1.5、佩樂能1.0及PEG 2a 3組的中位利巴韋林用量
對于體重≥75~85 kg的患者,佩樂能組聯合利巴韋林的實際用量顯著小于PEG2a 180組。佩樂能組聯合利巴韋林的中位實際用量為12.5 mg/kg,而PEG2a 180組為15 mg/kg。佩樂能組在該體重區間患者的SVR率也低于PEG2a 180組(36%對46%),而這種較低的SVR明顯與聯用利巴韋林累計用量較小有關(圖6)。
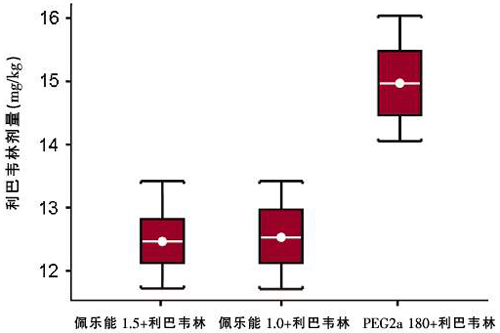
圖6 體重≥75~85 kg的患者,佩樂能組聯合利巴韋林的累計用量顯著小于PEG2a 180組
5.安全性
佩樂能1.5、佩樂能1.0和PEG2a 180 3組的總不良反應發生情況相似,無顯著差異(表3)。
表3 佩樂能1.5、佩樂能1.0和PEG2a 180 3組不良反應發生情況

IDEAL研究結論
1. 佩樂能標準劑量組、佩樂能小劑量組及PEG2a標準劑量組的SVR率相似。
2. 堅持888原則,佩樂能組可獲得更高的SVR率(分別為70%、74%和61%)。
3. 佩樂能1.5及佩樂能1.0組的復發率顯著低于PEG2a 180組(分別為24%、20%和32%),佩樂能組與PEG2a 180組間具有顯著統計學差異。
4. 佩樂能組在第4周、第12周及第48周的應答預測性更高,盡管PEG2a 180組在治療結束時取得了較高的應答率,但其復發率更高,而且PEG2a 180組的高復發率與利巴韋林用量無關。
5. PEG2a 180組累計利巴韋林用量[mg/(kg·d)]顯著高于佩樂能組。減量后,PEG2a 180組的利巴韋林用量仍顯著大于佩樂能組。
6. 3組治療方案總的安全性相似,但PEG2a 180組嚴重中性粒細胞減少發生率分別是佩樂能1.5和佩樂能1.0組的2~3倍。
TAG:佩樂能 IDEAL 丙型肝炎 聚乙二醇干擾素
相關藥品

十年全國連鎖專科藥房,藥監局認證網上藥店,分店覆蓋全國各大城市,數十位執業藥師免費用藥指導,網上買藥首選!
網站資訊- 藥房介紹 |
連鎖門店分布 | 人才招聘 |
聯系我們 | 網站地圖
便民幫助- 常見問題 | 服務指南 | 藥學服務 | 顧客意見 | 顧客投訴 | 專科服務 | 尋醫問藥 | 藥師窗口
專科分類服務- 腫瘤科 | 肝病科 | 神經科 | 精神科 | 皮膚性病科 | 眼 科 | 風濕免疫科 | 心血管科 | 糖尿病科 | 其他科用藥
藥品導購服務- 腫瘤科藥品 | 精神科藥品 | 肝病科藥品 | 眼科藥品 |皮膚性病科藥品 | 神經科藥品 | 風濕免疫科藥品
藥房資質- 企業法人營業執照 | 藥品經營許可證 | 藥品經營質量管理規范認證 | 食品衛生許可證 | 互聯網藥品信息服務資格證
便民幫助- 常見問題 | 服務指南 | 藥學服務 | 顧客意見 | 顧客投訴 | 專科服務 | 尋醫問藥 | 藥師窗口
專科分類服務- 腫瘤科 | 肝病科 | 神經科 | 精神科 | 皮膚性病科 | 眼 科 | 風濕免疫科 | 心血管科 | 糖尿病科 | 其他科用藥
藥品導購服務- 腫瘤科藥品 | 精神科藥品 | 肝病科藥品 | 眼科藥品 |皮膚性病科藥品 | 神經科藥品 | 風濕免疫科藥品
藥房資質- 企業法人營業執照 | 藥品經營許可證 | 藥品經營質量管理規范認證 | 食品衛生許可證 | 互聯網藥品信息服務資格證







