您現在的位置: 百濟新特藥房網首頁 >> 行業資訊 >> 媒體報道
丙肝大戰:CFDA批準第2家口服丙肝新藥上市
- 來源: 百濟藥房藥訊 作者:百濟動態 瀏覽: 發布時間:2017/8/31 15:08:00
原標題:丙肝大戰升溫:CFDA批準第2家口服丙肝新藥上市;默沙東Zepatier在中國遞交上市申請
8月28日,除了Gilead并購Kite的大新聞刷屏之外,對于中國丙肝藥市場也是極不平靜的一天。
強生西美瑞韋(Simeprevir)上市申請JXHS1600064的審批狀態變成“制證完畢-已發批件”,雖然暫未公布藥品批準文號,但據知情人士透露,Simeprevir已被CFDA批準上市。強生也是BMS之后第2家在中國上市口服丙肝新藥的藥企。
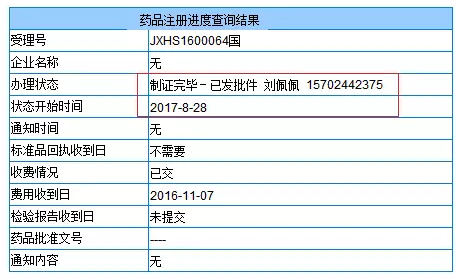
此外,默沙東丙肝新藥Zepatier在中國遞交的上市申請也在同一天獲得了CDE的承辦受理。不過在Zepatier的整個注冊過程中,其通用名比較多變。早是以MK-5172A的代號在中國遞交了丙肝新藥的臨床申請(JXHL1400223,2014/7/16),之后又分別以Elbasvir/Grazoprevir片(JXHL1600103,2016/9/12承辦)和依巴司韋格佐普韋片(JXHL1700001,2017/1/22承辦)的通用名提交了臨床申請。此次提交上市申請時的通用名則變成了艾爾巴格拉瑞韋片。
對于丙肝藥市場目前的狀況大家應該已經比較了解了,激烈的價格競爭和不斷涌現的新產品讓一年前還風光無限的幾家巨頭在今年上半年都開心不起來,Sovaldi、Harvoni、Viekira的銷售額在2017H1相比2016年同期全線大幅下滑。Zepatier雖然在上半年取得了8.95億美元的成績,但在AbbVie剛推出的26400美元/療程(8周)的全基因型丙肝新藥Maviret面前,價格優勢也基本無存。下半年能否維持這樣的業績也有很大壓力。在巨頭眼里,全球基本上也只剩下中國這個丙肝大市場尚未開發了。
不過中國丙肝藥市場的競爭同樣激烈。國內外幾家企業的口服丙肝藥產品上市申請均被CDE納入了優先審評,而且BMS在“阿舒瑞韋”+“達拉他韋”組合今年6月21日率先獲得批準上市后,馬上就與上海醫藥和保險機構合作開展了“按療效付費”創新保險項目等市場推廣工作。
在中國遞交上市申請的口服丙肝新藥
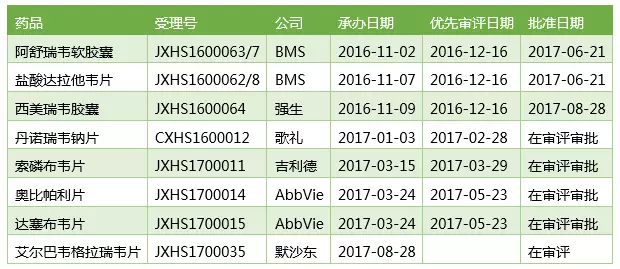

強生西美瑞韋的上市無疑會讓中國丙肝藥物市場的競爭升溫,而且索非布韋、丹諾瑞韋等品種也上市在即,屆時國外價格血拼的一幕或許會在國內重復上演。
來 源: 醫藥魔方數據
本文為轉載,我們不對其內容和觀點負責。









