您現在的位置: 百濟新特藥房網首頁 >> 腫瘤科 >> 新藥動態
達珂(地西他濱)
- 來源: 百濟藥房藥訊 作者:百濟動態 瀏覽: 發布時間:2010/1/29 2:53:00
達珂(地西他濱)分別于2006年4月和5月由歐洲EMEA和美國FDA批準上市,是用于治療原發性和繼發性骨髓增生異常綜合征(MDS)的藥物。該藥由MGI Pharma公司開發,英文商品名為Dacogen,英文通用名為decitabine,為注射劑。
達珂(地西他濱)為天然核苷2’-脫氧胞苷類似物。其化學名稱:1-(β- D-2-脫氧核糖)-4-氨基-1,3,5-三嗪-2(1H)-酮;英文名稱:4-amino-1-(2-deoxy-β-D-Erythro,pentofuranosyl)-1,3,5-triazin-2(1H)-one;分子式為C8H12N4O4;相對分子質量為228.2;CAS登記號為2353-33-5。

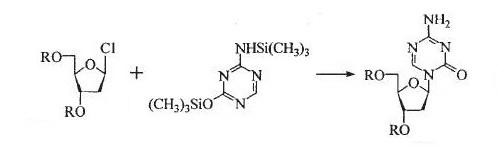
達珂(地西他濱)于1964年由Pliml和Sorm首次合成。文獻對其合成方法進行了報道,主要反應過程是三甲基硅烷保護的二氫-s-三嗪與氯代脫氧核糖在SnCl4的催化作用下縮合得到產物達珂(地西他濱)。
達珂(地西他濱)是一類低甲基化試劑,具有獨特的作用機制。達珂(地西他濱)經磷酸化后,直接摻入至DNA甲基轉移酶中,使DNA甲基化,導致細胞分化或凋亡,從而發揮抗腫瘤作用。它在體外不能抑制DNA的合成,而在腫瘤細胞內能引發低甲基化,且有維持基因的相關細胞分化和增殖控制功能。非增殖細胞對該藥相對不敏感。
達珂(地西他濱)是一種化療藥物,臨床報告顯示它對血液性惡性癌變及實體瘤具有廣譜抗腫瘤活性。該藥適用于治療MDS,適合于包括所有法國-美國-英國(FAB)分型的已接受治療和未接受治療的、新發病的和繼發性的MDS患者,以及按IPSS系統分為高危險、中度2級危險、中度1級危險的MDS患者。在達珂(地西他濱)注射液的Ⅲ期臨床試驗中,170位患者(有法國-美國-英國亞型和由國際預后積分系統預測的中危1級、中危2級、高危的骨髓增生異常綜合征的患者)的總體應答率為17%,包括9%的完全應答和8%的部分應答。接受達珂(地西他濱)治療的患者的總體體改善率(完全應答加部分應答和血液學改善者)為30%,而只接受支持治療的占7%。所有對達珂(地西他濱)應答的患者都不依賴于輸血,在經過達珂(地西他濱)治療的患者中,有35%的患者能觀察到細胞學的完全應答。達珂(地西他濱)在治療過程中最常見的不良反應是嗜中性白細胞減少、血小板減少和貧血。
2004年3月,SuperGen公司完成了達珂(地西他濱)治療MDS患者的Ⅲ期I晦床試驗,向FDA報批。MGI制藥公司與SuperGen公司達成協議,擁有該產品在全世界的獨占開發、生產和經銷權。兩公司目前正計劃將該藥應用到更多的血液腫瘤疾病的治療中。
TAG:達珂 地西他濱 骨髓增生異常綜合征
相關藥品








